Navigation auf uzh.ch
Navigation auf uzh.ch
Die Videoanimation der beiden Eiweissmoleküle H1 und ProTα gleicht dem schnellen Tanz zweier Partner, die sich fiebrig umwerben – mal etwas näher, mal mit etwas mehr Abstand (siehe Video am Schluss des Beitrags). Die biologische Bedeutung der beiden Proteine im Zellkern menschlicher Zellen gehört nicht zum Allgemeinwissen, aber ihre spezielle Art der Wechselwirkung sollte man sich merken: Die beiden Proteine haben keine geordnete Struktur und sind trotzdem in der Lage, sich gezielt miteinander zu verbinden. Damit widersprechen sie einem gängigen Dogma der Biologie und eröffnen einen neuen Blick auf die Proteinmaschinerie der Zelle.
Ben Schuler, Professor für Molekulare Biophysik am Biochemischen Institut der UZH, hat die erstaunliche Wirkungsweise der beiden Proteine zusammen mit seinem Team erforscht und vor knapp zwei Jahren in einem Nature-Artikel publiziert. Möglich wurde dies dank einzigartigen und diffizilen Detektionsmethoden, die Schuler in die Champions League der Biophysiker befördern. Wie die US-amerikanische Biophysical Society schreibt, wird der Wissenschaftler aufgrund seiner Entwicklungsarbeiten neuer Methoden zur Erforschung der Proteinfaltung ausgezeichnet. Wenn Schuler nächsten Februar in San Diego als Fellow in die Society aufgenommen wird, ehrt die Gesellschaft im speziellen seine langjährigen Verdienste um die sogenannte Einzelmolekül-Spektroskopie.
«Ich freue mich natürlich ausserordentlich über diese Anerkennung», sagt der 48jährige Ben Schuler in seinem Büro im Biochemischen Institut. Die Würdigung ist darüber hinaus auch eine persönliche Befriedigung und Bestätigung seiner Disziplinenwahl der Biophysik, über die in der Öffentlichkeit selten zu hören ist. «Als ich 1990 mein Studium begann, musste ich mich zwischen Physik und Biochemie entscheiden», erinnert er sich. Schuler wählte Biochemie in Regensburg und spezialisierte sich im Laufe des Studiums in Richtung Biophysik.
In dieser Disziplin beschäftigen sich die Forscherinnen und Forscher häufig mit der dreidimensionalen Struktur von Biomolekülen. Gemäss dem Prinzip «die Funktion folgt der Form» gibt die Kenntnis der Struktur Auskunft über die biologische Funktionsweise. Paradebeispiel ist die Doppelhelix der Erbsubstanz DNA, die 1953 von Francis Crick und James Watson aufgrund von Röntgenkristallogrammen erkannt wurde. Sie bildete die Basis zur Entschlüsselung des genetischen Codes.
Benjamin Schuler stürzte sich nach seinem Studium an der bayerischen Universität mit Elan in die Erforschung von Proteinen. Diese grossen Moleküle sind das Räderwerk in den Zellen und halten alle Prozesse und Strukturen in Gang. Millionen dieser Moleküle sind in einer einzelnen menschlichen Zelle am Wirken und die Entschlüsselung ihrer Struktur und Funktion ist eine der grossen Aufgabe der modernen Biologie. Traditionellerweise werden dazu die Moleküle kristallisiert und mit Röntgenstrahlen analysiert.
Die Kristallisation setzt allerdings voraus, dass die Moleküle eine geordnete, räumliche Struktur haben. Besitzen sie diese nicht, ist eine Kristallisation und damit die traditionelle Strukturanalyse unmöglich. Mit den gängigen Methoden sahen die Biophysiker somit nur einen Teil der Proteinmaschinerie, sie waren sozusagen auf einem Auge blind. Erst neue Methoden öffneten das Feld und ermöglichten den Blick auf sogenannt ungeordnete oder unstrukturierte Proteine.
Die Entdeckung erster Vertreter dieser neuen Klasse vor rund zwanzig Jahren war ein Paukenschlag, der die Biologen bis heute umtreibt. Lange Zeit wurde ihre Existenz in Frage gestellt, die Akzeptanz stieg erst nach und nach. Auch in den Lehrbüchern sind sie noch nicht angekommen, obwohl unstrukturierte Proteine rund 30 Prozent des gesamten menschlichen Proteoms ausmachen.
«Ungeordnete Proteine sind ein neues Paradigma und widersprechen dem bisherigen Verständnis», sagt Ben Schuler. Denn jahrelang galt der zentrale Grundsatz, dass die Funktion eines Proteins von seiner fixen dreidimensionalen Struktur abhängt. Dahinter steckt die Vorstellung, dass Proteine wie ein Schlüssel zum Schloss passen müssen, um an ihre Zielmoleküle anzudocken.
Ungeordnete Proteine weisen diese Erkennungsstrukturen nicht auf, sie besitzen dafür andere Bindungsmöglichkeiten. Im Fall der beiden anfangs genannten Moleküle sind es starke elektrostatische Anziehungskräfte in gewissen Bereichen, die sich aber auch während der Bindung laufend verändern.
Dank seiner Neigung zur Physik beschäftigt sich Ben Schuler vordringlich mit neuartigen Technologien, um unstrukturierte Proteine zu entschlüsseln. Einen Namen gemacht hat er sich mit der FRET-Methode zur Abbildung von Einzelmolekülen. FRET steht für Förster Resonanz Energie Transfer und basiert auf fluoreszierenden Farbstoffen, die an ein Protein angehängt werden. Nach Bestrahlung durch einen Laser kann aufgrund einer Energiewanderung zwischen den Farbstoffen auf die räumliche Struktur zurückgeschlossen werden. Im Unterschied zur Röntgenkristallisation lässt sich diese Methode an einzelnen Proteinen selbst innerhalb von lebenden Zellen anwenden.
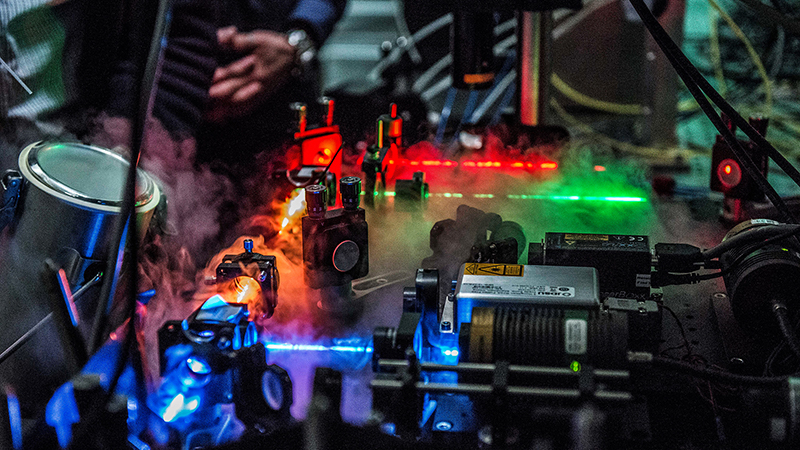
Die Technik ist nur dank hochempfindlichen Lichtdetektoren und ultraschneller Elektronik möglich; für die Analyse und Strukturentschlüsselung anhand der Messdaten sind leistungsfähige Superrechner nötig. Die Messmethoden benötigen ausserdem viel Fingerspitzengefühl zur Präparation der Moleküle. Speziell das Protein H1 nötigte Schulers Team jahrelanges Experimentieren ab.
Vom technischen Geschick der Gruppe profitiert die Universität ausserordentlich: Die UZH ist die einzige Hochschule in der Schweiz, die diese Technologie zurzeit in diesem Bereich anwenden kann.
Dank innovativen Forschern wie Ben Schuler explodiert dieses Feld zurzeit richtiggehend. Denn es zeigt sich, dass unstrukturierte Proteine bei vielen Krankheiten mit im Spiel sind. Zum Beispiel bei neurodegenerativen Erkrankungen wie Alzheimer oder Parkinson oder der Amyotrophen Lateralsklerose ALS.
Auch bei manchen Krebsarten spielen diese Proteine eine zentrale Rolle, so zum Beispiel über das Tumorsupressor-Protein p53, das am häufigsten involvierte Protein menschlicher Tumoren überhaupt. Seine Vielfältigkeit scheint geradezu von der ungeordneten Struktur abzuhängen, da es so an vielen möglichen Ansatzpunkten in der Zelle intervenieren kann und die Entartung begünstigt.
Mit den neuen Methoden eröffnen sich sowohl in der Grundlagen- als auch der angewandten Forschung bisher unbekannte Horizonte. Das World Economic Forum in Genf listet in seinem aktuellen «Insight Report» das Thema «ungeordnete Proteine und Krankheiten» unter den Top Ten Technologien des Jahres auf. Als Trendsetter hat Ben Schuler mitgeholfen, Licht in diesen «dunklen Bereich der Biologie» zu bringen.