Navigation auf uzh.ch
Navigation auf uzh.ch
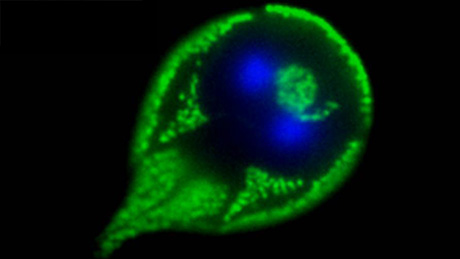
Einmal richtig ausmisten und alles wegwerfen, was sich so über die Jahre angesammelt hat und was man längst nicht mehr braucht. So eine Reinigungsaktion macht frisch und frei. Frisch und frei würde sich wohl auch der einzellige Parasit Giardia lamblia fühlen – wäre er denn in der Lage, irgendwelche Gefühle zu empfinden. Im Laufe der Evolution hat sich Giardia lamblia im Sinne von «use it or loose it» von einer «normalen» Zelle weiter entwickelt, hat ausgemistet und weggeworfen und dafür Neues, Nützlicheres angenommen. Wie Giardia lamblia mit dieser abgespeckten und abgeänderten Version einer Zelle funktioniert, untersucht Jon Paulin Zumthor, PhD-Student am Institut für Parasitologie an der Universität Zürich. Sein jetziges Forschungsprojekt wird dabei vom Forschungskredit der Universität Zürich unterstützt.

Giardia lamblia ist ein bekannter Parasit, der vor allem über verseuchtes Trinkwasser in seiner Dauerform als Zyste von Säugetieren und Vögeln aufgenommen wird. Im Dünndarm schlüpfen aus der Zyste begeisselte Parasiten, die an das Darmepithel haften und schwere Beschwerden wie Durchfall und Bauchkrämpfe auslösen können. Die WHO geht davon aus, dass pro Jahr etwa 300 Mio. Menschen an Giardia lamblia erkranken. Erkrankte scheiden den Parasiten wiederum in seiner Zystenform aus und stecken damit weitere Individuen an, zumal die Zysten bis vier Monate in der Umwelt überleben können.
Was Jon Paulin Zumthor interessiert, ist die Funktionsfähigkeit des Parasiten. Alles Überflüssige hat der Parasit über Bord geworfen. Anders als «normale» Zellen besitzt Giardia lamblia deshalb gewisse Zellorganellen nicht oder nicht mehr, wie zum Beispiel Mitochondrien oder den Golgi-Apparat. Neben dem Beschränken auf das Notwendigste hat sich der Parasit aber auch auf andere Weise seinen Lebensbedingungen angepasst. Im Gegensatz zu «normalen» Zellen nimmt er Stoffe nicht über die gesamte Oberfläche auf, sondern begrenzt die Nahrungsaufnahme auf die Oberseite und haftet dafür mit dem unteren Teil der Zelle mittels eines Saugnapfes an das Darmepithel.
Diese Nahrungsaufnahme, die sogenannte Endocytose, nimmt Zumthor genauer unter die Lupe. Bei den meisten anderen Zellen übernimmt bei diesem Vorgang das Protein Clathrin eine ganz bestimmte Funktion: Nimmt die Zelle einen Stoff auf, bindet dieser vorerst an einen Rezeptor an der Zelloberfläche und löst damit ein Signal aus. Clathrin wird mobilisiert und bewirkt, dass sich die Zellmembran am Ort des Rezeptors beziehungsweise der Rezeptoren einstülpt und ein stabiler Vesikel, ein Bläschen, gebildet wird. Sobald sich der Vesikel von der Zellmembran abgeschnürt hat, fällt das Clathrin von der Oberfläche des Vesikels ab und wird rezykliert.
In Giardia lamblia kommt Clathrin auch vor, allerdings funktioniert es dort anders; Clathrin fällt nicht vom Vesikel ab und wird rezykliert, sondern bleibt mit der Vesikeloberfläche verbunden und sorgt für ein stabiles Gerüst. Dieses Gerüst scheint dafür verantwortlich zu sein, dass das endocytotische Vesikel lange bestehen bleibt. «Warum Clathrin in Giardia lamblia auf der Vesikeloberfläche bleibt und wie es im stabilen Zustand funktioniert, welche Ähnlichkeiten und welche Unterschiede es zum Clathrin in anderen Zellen aufweist, das ist mein Forschungsgebiet», erklärt der Veterinärmedizinier Zumthor, der sich schon immer für Molekularbiologie interessierte.
Möglich ist, dass Clathrin im Sinne einer Exaptation in Giardia lamblia eine andere Funktion übernimmt als in anderen Zellen. Bei Vögeln zum Beispiel entstanden die Federn ursprünglich für die Thermoregulation, wurden aber später auch fürs Fliegen gebraucht. Ähnlich könnte Clathrin, ursprünglich für die dynamische Aufnahme von Stoffen in die Zellen verantwortlich, in Giardia lamblia eine statische und stabilisierende Funktion übernehmen.
Das Clathrin in Giardia lamblia zu untersuchen, ist gar keine einfache Sache. Parallel zur starken Reduktion des gesamten Zellinhaltes hat sich auch das Genom von Giardia lamblia sehr verändert. Viele Proteine, die in anderen Zellen als Interaktionspartner mit Clathrin bekannt sind, weisen in Giardia lamblia grosse Abweichungen in der Aminosäuren-Sequenz auf oder sind sogar verloren gegangen. Ausserdem macht die Tatsache, dass Giardia lamblia zwei Zellkerne und damit jeweils vier Allele für jedes Gen aufweist, bisher eine gezielte Proteinausschaltung unmöglich. Damit fällt die Möglichkeit weg, die Auswirkungen zu untersuchen, die eine Ausschaltung bestimmter Proteine zur Folge hätte. «Trotzdem ist unsere molekulare Werkzeugkiste gut gefüllt», sagt Zumthor und ist zuversichtlich, das Geheimnis von Clathrin in Giardia lamblia zu lüften.