Navigation auf uzh.ch
Navigation auf uzh.ch

Rolf Kümmerli ist fasziniert von Gruppendynamiken. Er beobachtete Primaten, analysierte das Sozialverhalten von Ameisen, und nun richtet er sein wissenschaftliches Augenmerk auf Bakterien. Doch wie interagieren Einzeller miteinander? «Sie kommunizieren und kooperieren, indem sie wachstumsfördernde Moleküle ausstossen, die wir messen können», sagt Rolf Kümmerli, einer von sieben Förderungsprofessuren des Jahres 2012 an der Universität Zürich.
Er arbeitet mit der Bakterienart Pseudomonas aeruginosa, einem Krankheitserreger, dessen Genom bereits entschlüsselt ist und deren wachstumsfördernde Moleküle sich gut beobachten lassen, weil sie unter dem Mikroskop blau fluoreszieren.
Aufgrund seines aggressiven Wachstums ist das Bakterium Pseudomonas aeruginosa in Krankenhäusern gefürchtet. Es ist schwierig, ihm beizukommen, weil es gegen Antibiotika resistent ist und Desinfektionsmitteln ihm wenig anhaben können. Siedelt es sich nun zum Beispiel auf Brandwunden an, kann es einem Patienten schwer zu schaffen machen, vor allem wenn sein Immunsystem geschwächt ist.
Das Bakterium ist weit verbreitet, es kommt im Boden und im Wasser vor. Von Wissenschaftlern wird es auch als opportunistisch pathogen bezeichnet, das heisst, es kann lange auch ohne Wirt überleben; sobald es jedoch auf geschwächtes Gewebe – wie zum Beispiel offene Wunden – trifft, besiedelt es dieses und kann grossen Schaden anrichten.
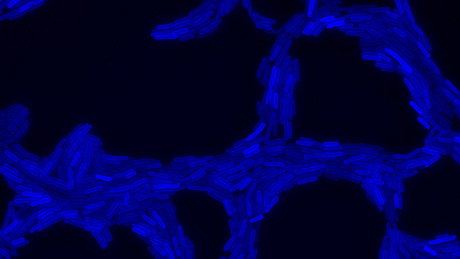
Speziell interessiert Kümmerli, wie die Bakterien das für sie lebenswichtige Eisen aufnehmen. Da Bakterien ohne Eisen nicht wachsen können, sondern sie Moleküle ab, die das Eisen des Wirts aus dem Gewebe lösen. Damit können sie wachsen und sich teilen. Neue Bakterien tuen es ihren Müttern nach, geben Moleküle ab und teilen sich. Mit der Zeit wachsen alle zu einer grossen Bakterienpopulation heran. Bei diesem Prozess werden toxische Substanzen freigesetzt, die den Wirt angreifen und bei ihm Entzündungen des Gewebes hervorrufen können.
Kümmerli hat nun im Labor etwas Interessantes beobachten können: Es gibt in jedem Bakterienstamm genetische Mutanten, die keine Eisen lösende Moleküle mehr ausstossen. Damit sparen sie Energie und übervorteilen quasi ihre Mit-Bakterien, die weiterhin diese Moleküle produzieren.
Diese «Schmarotzer» haben gegenüber den anderen Bakterien einen Fitnessvorteil, weil sie keine Moleküle produzieren müssen, das Eisen aber immer noch aufnehmen können: Sie haben den Nutzen, jedoch keine Kosten. Deshalb nehmen sie mit der Zeit überhand, was sich wiederum schlecht auf die Gesamtpopulation auswirkt. Zu viele Mutanten bedeuten eine Reduktion der Eisenaufnahme und letztendlich den Tod der Population.
Doch was für die Bakterien schlecht ist, ist gut für den Wirt. Könnte man nun das Wachstum der Mutanten im Wirtsgewebe fördern, wäre dies ein Ansatzpunkt, um Kranken mit einer P. aeruginosa-Entzündung zu helfen: Die Bakterienpopulation würde unter dem Übergewicht der egoistischen «Nutzniesser-Bakterien» zusammenbrechen.
Im Moment experimentiert Kümmerli mit einfachen Wirtstieren wie Insektenlarven und beobachtet den Verlauf der Infektion und das Verhalten der Bakterien.
Eine weitere Frage beschäftigt den Evolutionsbiologen: Warum gibt es überhaupt Schmarotzer? Warum wurden sie im Laufe der Evolution nicht längst abgeschafft? Kümmerli vermutet, dass die Schmarotzer die evolutionäre Entwicklung der Bakterien anstacheln. Gibt es nämlich sehr viele Schmarotzer, müssen die anderen Bakterien darauf reagieren, beispielsweise ihre Kooperation verbessern, um ihr Bestehen zu sichern.