Navigation auf uzh.ch
Navigation auf uzh.ch
Schmerzhafte Reize werden vom Körper durch bestimmte Rezeptoren in der Haut, den Muskeln, Gelenken und den inneren Organen wahrgenommen. Spezialisierte Nervenfasern leiten diese Signale dann von der Peripherie ans Gehirn weiter. Dort wird der Schmerz bewusst wahrgenommen. «Das Rückenmark ist als eine Art Schmerzfilter dazwischen geschaltet», sagt Hanns Ulrich Zeilhofer, Professor am Institut für Pharmakologie und Toxikologie der Universität Zürich und Institut für Pharmazeutische Wissenschaften der ETH Zürich. Es verhindert, dass nicht schon normale Berührungen als Schmerz wahrgenommen werden.
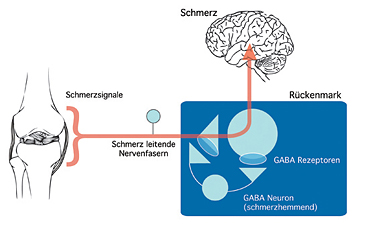
Dabei setzen Schmerz hemmende Nervenzellen im Hinterhorn des Rückenmarks den Botenstoff gamma-Aminobuttersäure (GABA) frei. Dies geschieht an den Kontaktstellen zu benachbarten Nervenzellen, den sogenannten Synapsen. Dieser Botenstoff aktiviert auf den benachbarten Nervenzellen Chloridkanäle (GABA-A Rezeptoren) und hemmt so die Aktivität der Nervenzellen, die den Schmerz ans Gehirn weiterleiten.
Bei Patienten mit chronischen Entzündungskrankheiten, wie rheumatoider Arhritis, oder Nervenschädigungen, zum Beispiel nach Unfällen, ist die Schmerz hemmende Wirkung von GABA stark reduziert. Die Schmerzreize werden dann nahezu ungefiltert an das Gehirn weitergeleitet. Benzodiazepine, wie das Beruhigungsmittel Valium®, die die Wirkung von GABA verstärken, können chronische Schmerzen lindern, wenn sie direkt in das Rückenmark injiziert werden.
Praktisch ist dies jedoch nur selten möglich. Werden die Benzodiazepine aber als Tabletten verabreicht, wirken sie nicht nur lokal im Rückenmark, sondern auch im Gehirn. Dort verursachen sie in der Schmerztherapie unerwünschte Nebenwirkungen. Sie machen müde, reduzieren die Merkfähigkeit und können abhängig machen. Bei chronischer Therapie verlieren sie zudem mit der Zeit ihre Wirkung. Die klassischen Benzodiazepine sind deshalb für die Therapie von chronischen Schmerzen ungeeignet.
Obwohl man seit einigen Jahren weiss, dass GABA in der Schmerzkontrolle eine wichtige Rolle spielt, nutzte man bis anhin die GABA-Rezeptoren kaum als Ausgangsbasis, um darauf neue Schmerztherapien zu entwickeln. Das Forscherteam unter Leitung von Ulrich Zeilhofer versuchte nun den Beitrag der GABA-Rezeptoren zur Schmerzkontrolle im Rückenmark genauer zu entschlüsseln. Sie publizierten die Ergebnisse ihrer Studie in der jüngsten Ausgabe der Fachzeitschrift «Nature».

Bereits zuvor war bekannt, dass mindestens vier verschiedenen Subtypen der GABA-Rezeptoren auf Benzodiazepine ansprechen. «In früheren Versuchen hat bereits Uwe Rudolph, heute Professor an der Harvard Medical School und damals Mitarbeiter von Hanns Möhler, Professor am Institut für Pharmakologie und Toxikologie der Universität Zürich, zwei der Subtypen identifiziert», sagt Zeilhofer. «Den, der die Angst lösende Wirkung der Benzodiazepine vermittelt, und den, der sedierend wirkt.»
Hierfür hatte Rudolph Mäuse genetisch manipuliert. Er tauschte einzelne Aminosäuren der GABAA-Rezeptoren aus und machte sie dadurch unempfindlich gegenüber den Benzodiazepinen.
Nun machte sich das Team um Zeilhofer mit Hilfe dieser genmanipulierten Mäuse auf die Suche nach den GABA-Rezeptoren, die verhindern, dass Schmerzen ans Gehirn weitergeleitet werden. Bei den Tieren wurde zuerst eine Entzündung in der Pfote ausgelöst oder der Ischias-Nerv gereizt. Dann wurde ein Schmerz lindernder Wirkstoff aus der Gruppe der Benzodiazepine in das Rückenmark verabreicht.
Das Verhalten der Tiere ermöglichte den Forschern die Rezeptoren zu bestimmen, die die Schmerzlinderung vermitteln. Sie konnten zwei Subtypen der GABAA-Rezeptoren identifizieren, die im Rückenmark die Schmerzempfindung kontrollieren. «Wir waren sehr erfreut, als wir sahen, dass sie verschieden von denen waren, die sedierend wirken oder abhängig machen», sagt Zeilhofer.
Für den Einsatz im Tierexperiment stehen bereits Wirkstoffe zur Verfügung, die die gewünschte Rezeptorspezifität aufweisen. Andreas Hess, Privatdozent und Kay Brune, Professor, von der Universität Erlangen-Nürnberg, haben die Wirkung einer dieser Substanzen mit Hilfe neuster Bild gebender Verfahren an Ratten untersucht. Die funktionelle Magnetresonanztomographie macht Schmerzen und ihre medikamentöse Beeinflussung im Gehirn sichtbar.
Die Experimente bestätigten, dass die so stimulierten GABA Rezeptoren die Schmerzleitung ins Gehirn tatsächlich verminderten. Langzeitstudien zeigten zudem, dass der untersuchte Wirkstoff auch bei länger dauernder Therapie seine Wirkung behielt und keine Abhängigkeit hervorrief.
Gelänge es ein Medikament für die Anwendung am Menschen zu entwickeln, das nur diese zwei Subtypen von GABA Rezeptoren anspricht, wäre das ein gewaltiger Fortschritt in der Schmerztherapie. Chronische Schmerzen könnten gezielt und mit weniger Nebenwirkungen behandelt werden. «Nun ist es eine Herausforderung für die Pharmaindustrie einen solchen Wirkstoff bis zur therapeutischen Anwendung beim Menschen zu bringen», sagt Zeilhofer.