Navigation auf uzh.ch
Navigation auf uzh.ch
Die septische Granulomatose ist eine von mehreren tausend angeborenen Erbkrankheiten, die auf einem Defekt im Erbgut – den Genen - beruhen. Im Falle der septischen Granulomatose bewirkt ein Gendefekt, dass eine bestimmte Sorte Abwehrzellen des Immunsystems – die Fresszellen - gegenüber Pilzen und gewissen Bakterien nicht richtig funktioniert. In der Folge erleiden die Betroffenen schwere und wiederkehrende Infektionen, die zu Tod und Invalidität führen. Je nach Vererbungsmodus unterscheidet man zwei Formen der Erkrankung – eine X-(Geschlechts)-Chromosom-gebundene und eine nicht Geschlechts-Chromosom (Autosom) gebundene Form.
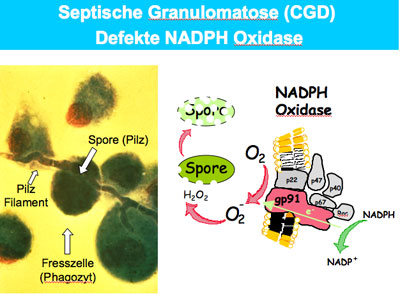
Die herkömmliche Therapie der septischen Granulomatose ist die Knochenmarkstransplantation, doch diese setzt einen gewebskompatiblen Spender voraus, was oft nicht gegeben ist. Dann bleibt nur die lebenslange vorbeugende Gabe von Antibiotika und Medikamenten gegen Pilzinfektionen. «Doch trotz optimaler Medikamenteneinnahme sterben jedes Jahr zwei bis fünf Prozent der Betroffenen», schildert Janine Reichenbach die bisherige Situation. Die Oberärztin am Universitätskinderspital arbeitet mit Unterstützung des Forschungskredits an der Verbesserung der Gentherapie der septischen Granulomatose.
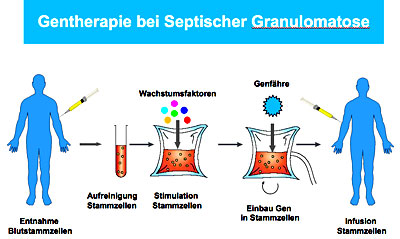
Das Wirkprinzip der Gentherapie beruht darauf, den Betroffenen eine funktionsfähige Variante des defekten Genes in ihre Körperzellen einzuschleusen und damit direkt die Ursache der Krankheit zu beheben. Bei der Gentherapie der chronischen Granulomatose werden hierzu den Patienten Blut-Stammzellen entnommen. Blut-Stammzellen sind die Vorläufer verschiedener Typen von Blut- und Abwehrzellen, so auch der Fresszellen. Im Labor werden in die Blut-Stammzellen die intakten Gene eingeschleust. «Um in die Zellen zu gelangen, brauchen die intakten Gene ein geeignetes Transportmittel. Dieses könnte man als Genfähre bezeichnen», erläutert Janine Reichenbach den Fokus ihrer Forschungsarbeit.
Als solche Genfähren setzen die Forscher Viren ein. Diese sind in der Lage, wie bei einer Infektion, ins Innere von Zellen zu gelangen. In die Viren bringen die Forscher zuvor eine intakte Variante des defekten Gens ein. Die Viren sind zudem nicht mehr in der Lage sich zu vermehren, so dass es zu keiner tatsächlichen Infektion mit Vermehrung von Viren und dem Abtöten der virusinfizierten Zellen kommen kann. Indem die Viren die Blut-Stammzellen infizieren, bringen sie in diese eine intakte Kopie des bei den Patienten defekten Gens ein. Das Gen baut sich in der Folge in die Erbsubstanz der Blut-Stammzellen ein. In der Zwischenzeit werden die Patienten einer milden Chemotherapie unterzogen, um die bestehenden Blut-Stammzellen mit defektem Gen zurück zu drängen und damit Platz zu schaffen für die neuen Blut-Stammzellen mit dem intakten Gen, die den Patienten schliesslich zurück ins Blut gespritzt werden.
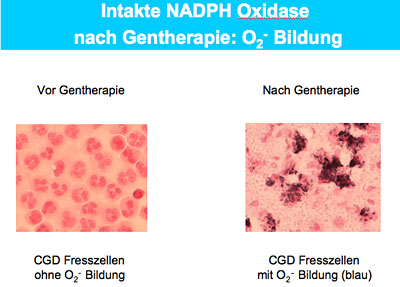
Auf diese Weise war es einer Forschungsgruppe um Professor Reinhard Seger am Universitätskinderspital Zürich vor einem Jahr gelungen, einen schwer kranken fünfjährigen Knaben zu therapieren. Der Knabe litt aufgrund einer septischen Granulomatose an einer Pilzinfektion der Lunge, die in die Wirbelsäule durchbrach. «Er konnte seine Beine kaum mehr bewegen, dank der Therapie kann der Junge heute wieder kürzere Strecken laufen und Fussball spielen», schildert Reichenbach eindrücklich den Erfolg der angewandten Gentherapie. Der fünfjährige Junge ist laut Janine Reichenbach seither infektfrei, denn nur wenige Prozente korrigierter Fresszellen reichen aus, um Infekte zu verhindern.
Am mit Zürich kooperierenden Zentrum in Deutschland wurden von Dr. Marion Ott und Dr. Manuel Grez zwei erwachsene Patienten auf dieselbe Weise behandelt. Einer der beiden erkrankte trotz der Therapie erneut an einer Infektion und verstarb. Die Zürcher Forscher arbeiten nun intensiv daran, jene Genfähre zu identifizieren, die das intakte Gen am effizientesten in die Blut-Stammzellen einzuschleusen vermag. Für nächstes Jahr ist geplant, weitere Patienten zu behandeln. Vorgängig wollen die Zürcher Forscher nebst der Wirksamkeit auch die Sicherheit weiter erhöhen. Denn neben dem Nutzen birgt die Gentherapie von Blut-Stammzellen das Risiko in sich, mit der Behandlung Blutkrebs auszulösen. Dies hatte die Gentherapie von 18 Kindern mit einer anderen Immunschwächekrankheit in Paris und London gezeigt. Bei drei Patienten hatten die Genfähren Wachstumsgene aktiviert, was bei diesen zu einer unkontrollierten Zellvermehrung und damit zur Leukämie geführt hatte. Das vom Forschungskredit unterstützte Projekt verfolgt somit das Ziel, die wirksamste und gleichzeitig sicherste Genfähre für die X-chromosomal gekoppelte Form der Erkrankung zu identifizieren.
Gleichzeitig wird in der Abteilung mithilfe eines zweiten durch den Forschungskredit unterstützten Projektes seit 2006 durch Dr. Ulrich Siler die Gentherapie der autosomal gebundenen Form der Erkrankung entwickelt.