Navigation auf uzh.ch
Navigation auf uzh.ch
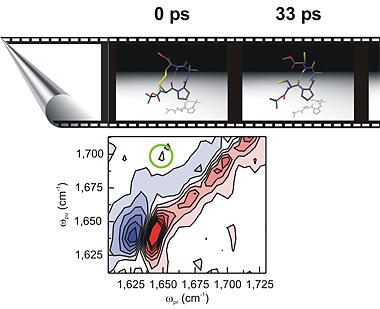
Moleküle sind so klein, dass sie nur über Umwege sichtbar gemacht werden können. Ein solcher Umweg kann darin bestehen, sie mit Licht zu bestrahlen. Das Licht wird von den Molekülen zum Teil absorbiert – der nicht absorbierte Teil zeigt sich in der Form eines Farbspektrums, welches für jedes Molekül anderes aussieht und Rückschlüsse auf seine Struktur erlaubt.
Die Forschungsgruppe von Professor Peter Hamm vom Physikalisch-Chemischen Institut der Universität Zürich präsentiert in der aktuellen Ausgabe der Zeitschrift «Nature» eine neuartige Form dieser Spektroskopie. Die «zweidimensionale Infrarotspektroskopie» ermöglicht es erstmals, die rasend schnell ablaufenden Veränderungen in der Struktur von Proteinen sichtbar zu machen. Diese Veränderungen, von denen man bisher nur aus theoretischen Berechnungen weiss, vollziehen sich in Zeitspannen von Pikosekunden (10-12s). Ihre experimentelle Beobachtung und Verifizierung erweist sich deshalb bisher als extrem schwierig.

Mit der neuen Technik können solche Veränderungen nun sozusagen «gefilmt» werden. Die «zweidimensionale Infrarotspektroskopie» baut auf der schon seit langem bekannten Infrarotspektroskopie auf, verwendet jedoch eine sehr schnelle Abfolge von zwei extrem kurzen Infrarot-Lichtimpulsen. Die einzelnen Bilder geben Aufschluss darüber, ob zwei molekulare Gruppen zu einem bestimmten Zeitpunkt räumlich benachbart sind oder nicht, damit können Rückschlüsse über den räumlichen Abstand von zwei Gruppen des Proteins und somit über dessen Struktur gezogen werden.
Erstmals demonstriert haben die Forschenden die neue Analysemethode an einem Modellbeispiel, das am Lehrstuhl für Organische Chemie von Professor Wolfram Sander an der Universität Bochum synthetisiert wurde.
Die neue Technik wird mithelfen, die aus theoretischen Berechnungen bekannte Dynamik von Proteinen experimentell zu beobachten. «Die zweidimensionale Infrarotspektroskopie ist ein Meilenstein auf dem Weg zu unserem Ziel, die Struktur von Molekülen besser zu verstehen», so Peter Hamm. Im nächsten Schritt soll die neue Analysemethode nicht nur wie in der Entwicklungsphase auf Peptide, das sind kleine Proteine, sondern auf grössere Proteine und konkrete Fragestellungen angewandt werden. «Wir wollen zum Beispiel untersuchen, wie der Prozess der Proteinfaltung genau vor sich geht. Für die Grundlagenforschung ist es von grossem Interesse, welche Kräfte und Mechanismen auf dem Weg vom eindimensionalen Strang von Aminosäuren zur jeweils spezifischen Form eines Proteins mitspielen», so Hamm.