Navigation auf uzh.ch
Navigation auf uzh.ch
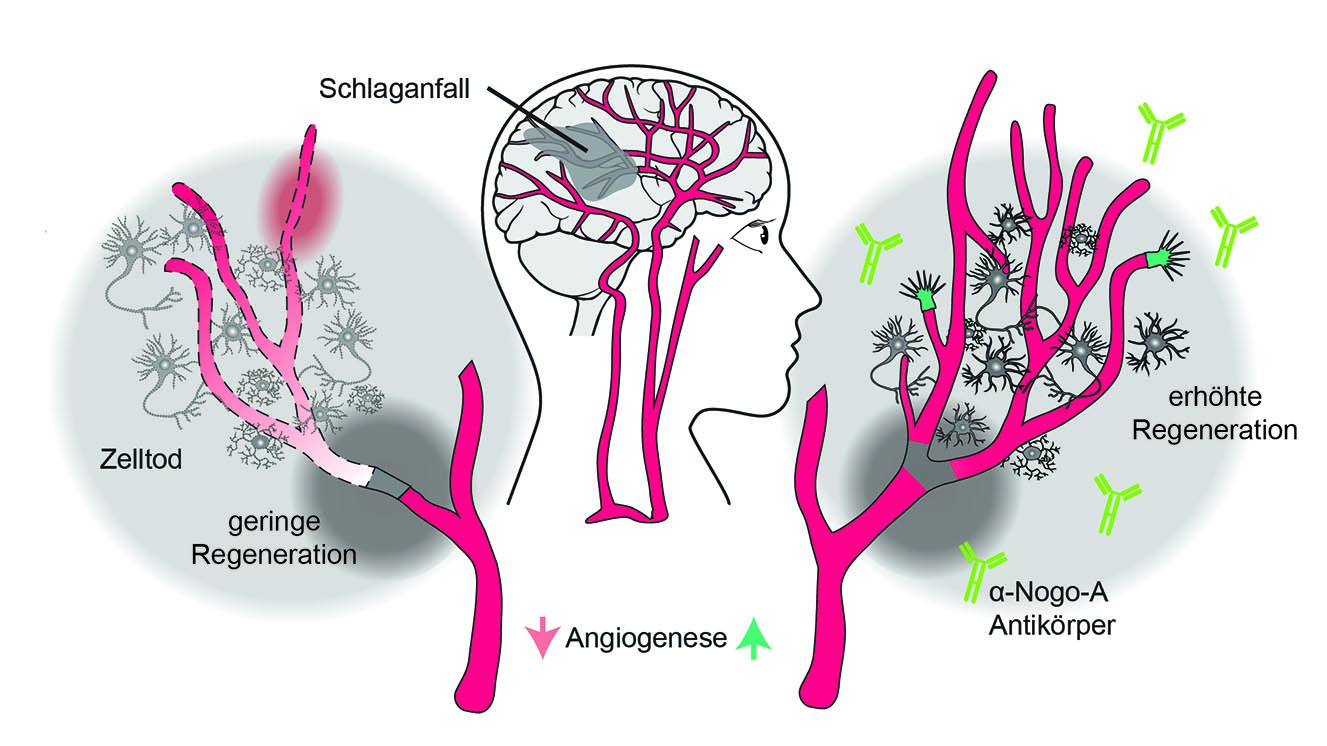
In der Schweiz erleiden jedes Jahr rund 16‘000 Menschen einen Hirnschlag, weltweit sind es 15 Millionen. Zwei Drittel der Betroffenen sterben oder bleiben dauerhaft pflegebedürftig, da das Gehirn nur begrenzt in der Lage ist, beschädigtes Gewebe oder neuronale Schaltkreise zu regenerieren. Medikamentöse Therapiemöglichkeiten, die Folgeschäden nach einem Hirnschlag verringern, sind bislang kaum verfügbar und Gegenstand intensiver Forschung.
Ein vielversprechender Ansatz, um das Wiedererlangen eingeschränkter Körperfunktionen zu fördern, zielt darauf ab, das Gefässsystem im betroffenen Hirnbereich zu reparieren. Dieses versorgt das verletzte Gewebe mit Sauerstoff und wichtigen Nährstoffen. Doch nach einem Hirnschlag hemmen verschiedene Mechanismen diese Reparatur. Im Mäusemodell zeigte die Forschungsgruppe von UZH-Professor Martin Schwab vor wenigen Jahren, dass beispielsweise das Signalmolekül Nogo-A nicht bloss das Wachstum von Nervenfasern verringert, sondern auch die Entwicklung von Blutgefässen im Gehirn reguliert und so auch deren Reparatur bremsen könnte.
In einer neuen Studie mit Mäusen deaktivierten die Forschenden das Nogo-A-Molekül respektive den korrespondierenden Rezeptor S1PR2 genetisch. Die Blutgefässe der so veränderten Tiere wuchsen nach einem Hirnschlag besser nach und sie waren motorisch geschickter als die Mäuse in der Vergleichsgruppe. Diese Resultate reproduzierten die Wissenschaftler in einem zweiten Schritt in einem therapeutischen Ansatz: Sie verabreichten Mäusen nach einem Hirnschlag Antikörper gegen das Nogo-A-Molekül. Auch dies führte zur Bildung eines robusten und funktionellen Netzwerks von Blutgefässen rund um den betroffenen Hirnbereich. «Das Nervensystem der behandelten Mäuse erholte sich besser und ihre Bewegungen waren weniger eingeschränkt, was wir auf die Regeneration der Blutgefässe zurückführen», sagt Erstautor und UZH-Neurowissenschaftler Ruslan Rust.
Bisherige experimentelle Therapieansätze fokussierten primär auf den Einsatz von Wachstumsfaktoren, welche die Neubildung von Blutgefässen fördern – eine Vorgehensweise, die sich aufgrund unerwünschter Nebeneffekte wie erhöhten Blutungsrisken als klinisch nicht tragfähig erwiesen hat. «Unsere Erkenntnisse liefern nun eine vielversprechende alternative Behandlungsperspektive für Hirnschlagpatienten», so Rust, «nicht zuletzt, weil Antikörper gegen Nogo-A in einer klinischen Phase-II-Studie bei Rückenmarksverletzungen bereits verwendet werden.»
Ruslan Rust et al. Nogo-A Targeted Therapy Promotes Vascular Repair and Functional Recovery Following Stroke. PNAS. June 24, 2019. DOI: 10.1073/pnas.1905309116