Navigation auf uzh.ch
Navigation auf uzh.ch
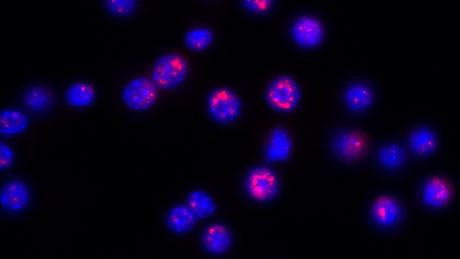
Sind Zellen Stress ausgesetzt, werden verschiedene Reparatur- und Entgiftungsprozesse in Gang gesetzt, damit sich die Zellen vor Schädigungen schützen können. Stress wird durch Umweltfaktoren oder durch die körpereigene Reaktion auf Entzündungen verursacht, was zu Krebs oder Herzkrankheiten führen kann. Die Zellen reagieren, indem sie diverse Proteine chemisch modifizieren, so dass sich deren Aktivität und Funktion verändert. Zentral in dieser Stressantwort ist die ADP-Ribosylierung: Enzyme fügen dabei an bestimmten Stellen eines Proteins kleine Moleküle an oder entfernen sie, womit das Protein aktiviert oder deaktiviert wird. Dieser Schritt löst eine Kaskade von Prozessen aus, mit denen sich die Zelle dem Stress anpasst, um zu überleben.
Besonderes Augenmerk gilt unter anderem dem Schutz der Chromosomen, den Trägern der Erbinformation. Diese bestehen einerseits aus der genetischen Information sowie andererseits aus diversen Proteinen, um die die fadenförmige DNA gewickelt ist, dem Chromatin. Seit langem ist bekannt, dass einige der Chromatin-Proteine unter bestimmten Stressbedingungen ADP-ribosyliert werden, was der Zelle hilft, Stress-induzierte Schädigungen zu bewältigen. Doch wo genau die ADP-Ribosylierung am Chromatin stattfindet, war bislang unklar. Geeignete Verfahren, um diese Frage zu beantworten, fehlten.
Eine Gruppe von Wissenschaftlern des Instituts für Molekulare Mechanismen bei Krankheiten (ehemals Institut für Veterinärbiochemie und Molekularbiologie) der Universität Zürich hat nun eine neue Methode mit dem Namen «ADPr-ChAP» entwickelt, die den Nachweis der modifizierten Chromatin-Stellen erlaubt, die nach Zellstress entstehen. «Damit können wir genauer untersuchen, wo und wie die ADP-Ribosylierung die Struktur des Chromatins reguliert und diverse Prozesse wie die Vervielfältigung der DNA, deren Reparatur oder die Genaktivität steuert», erläutert Prof. Michael O. Hottiger, Leiter der Studie.
«Mit dieser Technik lässt sich viel detaillierter erforschen, welche Proteine ADP-ribosyliert werden – sowohl in Bezug auf das gesamte Genom wie auch an spezifischen Stellen. Und dies ermöglicht es, besser zu verstehen, wie eine Zelle auf einen bestimmten Stress reagiert», fasst Hottiger zusammen. Damit steht der Wissenschaft nun ein zuverlässiges Instrument zur Verfügung, um jene molekularen Signalwege zu identifizieren, die bei zellulären Stressreaktionen eine zentrale Rolle spielen. Langfristiges Ziel der Forschenden ist es, neue Möglichkeiten zu finden, um gezielt die krankmachenden Prozesse im Körper, beispielsweise bei chronischen Entzündungen oder Krebserkrankungen, zu unterbinden.
Giody Bartolomei, Mario Leutert, Massimiliano Manzo, Tuncay Baubec, and Michael O. Hottiger. Analysis of Chromatin ADP-Ribosylation at the Genome-wide Level and at Specific Loci by ADPr-ChAP. Molecular Cell, January 28, 2016. doi:10.1016/j.molcel.2015.12.025